外泌体可用于癌症监测和功效评估的生物标记
外泌体含有丰富的蛋白质,除了其来源细胞从头合成的蛋白,还包含其它细胞的蛋白,并具有以下特性,使其有希望成为用于癌症监测和功效评估的生物标记。
1、外泌体中与癌症相关的蛋白、脂质、mRNA、非编码 RNA、DNA 可用于检测癌症;
2、外泌体体积小,具有优越的穿过各种组织屏障的能力,比如血脑屏障、且广泛存在于各种体液中,便于获取和检测;和合成的纳米颗粒相比,外泌体具有更好的生物相容性和生物可降解性,因此具有低毒性和低免疫原性;外泌体在肿瘤细胞内的粘附性和内化性比同等大小的脂质体高 10 倍,表明外泌体对癌症的靶向性更高;
3、外泌体的脂质双分子层结构可有效保护其内容物不被血液循环中的酶降解。有研究报道,冷冻 5 年的外泌体中仍然可以分离出完好的磷酸化蛋白;
4、血液中的成分很复杂,癌细胞分泌的特定蛋白等生物分子在血液中被稀释,因此在早期阶段或其含量较低时,不容易被检测到,但外泌体有膜包裹,且可被完整分离出来,其携带的分子不会被稀释;
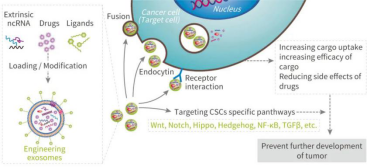
5、外泌体和与肿瘤靶向蛋白、多肽或抗体一起进行基因工程编辑,用于更佳精准的治疗药物的递送。
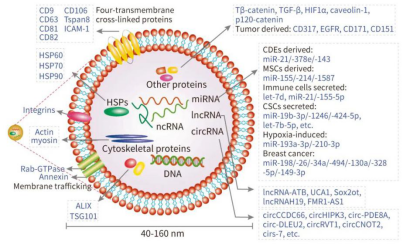
外泌体标记物
外泌体中非编码 RNA 的研究也越来越火热,例如转移性胃癌细胞系 AZ-P7a 通过外泌体释放 let-7 miRNA (肿瘤抑制 miRNA) 进入细胞外环境中,从而维持肿瘤发生进程。外泌体来源的 miR-198、miR-26a、miR-34a 和 miR-494 在 MCF-7 乳腺癌细胞系中丰量表达,而 miR-130a、miR-328–5p 和 miR-149-3p 在 MDA-MB-231 乳腺癌细胞系中表达量很高。这些 miRNA 都有潜力成为乳腺癌诊断的生物标记分子。
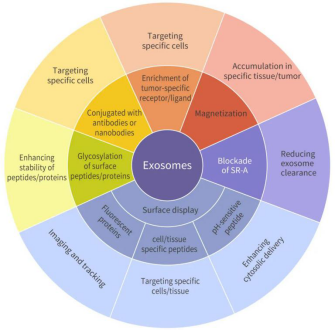
药物载体
应用案例:
实例一:促进 KRAS 突变的胰腺癌靶向治疗—通过基因工程的方法,在外泌体中转入靶向 KRASG12D 的 siRNA 或 shRNA (称为 iExosome),在多种胰腺癌模型中表现出良好的疗效。经Exosome 治疗的胰腺癌小鼠,其肿瘤生长明显抑制,且 iExosome 不影响原位 BxPc-3 KRASWT 肿瘤的生长。和传统的 RNAi 药物载体脂质体相比,iExosome 更加高效,一方面,因为外泌体作为纳米级的囊泡,更加自如轻松的在体内循环作用靶细胞;另一方面,要归功于 CD47 介导的保护作用使外泌体免受单核细胞和巨噬细胞的吞噬,从而到达靶向部位。
实例二:修饰外泌体表面提高靶向性—来自人胚肾细胞 (HEK293) 的外泌体含有 GE11 肽和 let-7a,GE11 可与 EGFR 受体结合。使用近红外染料 DiR 标记外泌体, 并通过体内成像系统和体外检测外泌体迁移过程发现,到达肿瘤细胞的外泌体中,含有 GE11 的外泌体是对照组的 3 倍。且注射组小鼠在组织学上未发现明显损伤。
此外,和对照组 (注射对照 miRNA 的外泌体) 相比,含有 let-7a 的 GE11 阳性外泌体显著抑制了肿瘤的生长 (let-7a 是一个肿瘤抑制 miRNA, 通过下调 HMGA2 或 RAS 家族成员,如 K-Ras、H-Ras 和 N-Ras 的表达来抑制肿瘤的发展)。表明了,GE11 阳性外泌体可促进体内治疗分子 (如 let-7a) 向表达 EGFR 的肿瘤细胞传递。
实例三:基因工程改造内容物—— 研究显示,利用来自小鼠未成熟的树突状细胞产生外泌体 (低毒性) ,通过基因改造使其表达外泌体膜蛋白 Lamp2b 并融合 αv 整合素-特异性 iRGD 多肽,而表达 iRGD 的外泌体在体外可高效靶向 αv 整合素阳性的肿瘤细胞并特异性的递送 Dox ( Doxorubicin ) 至肿瘤组织,有效抑制癌细胞生长并无明显毒性,揭示了基因工程改造内容物具有巨大的临床潜力。
来源:本文部分来源网络,版权归相关权利人所有,如侵权,请联系!
wyf 01.14






