蛋白质交联剂的使用方法和应用方向(转)
蛋白质交联剂分为三大类:同源交联剂,异源交联剂,光反应交联剂。
使用方法
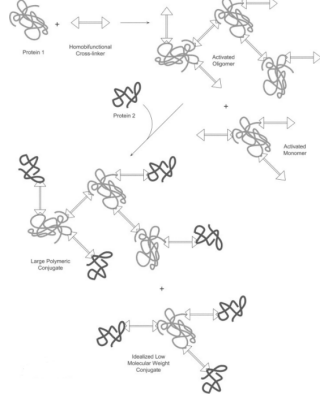
图示为同源交联剂的使用方法:将待交联的蛋白质A与交联剂在一定条件下反应,得到的蛋白质A-交联剂中间体,然后移除多余的交联剂,再加入欲交联的蛋白质B。产物中可能会形成多聚体,这一副产物通过调节反应条件来控制。分成两部反应的目的在于减少分子内交联以及形成蛋白质多聚物。另外,选择异源交联剂也可以减少多聚物的产生。
应用
蛋白质交联剂已有广泛应用于生命科学研究的各个分支。
蛋白质间相互作用研究
大多数蛋白质–蛋白质结合相互作用是瞬时的,通过交联方法可以稳定或永久连接相互作用复合物中的成分,从而有助于鉴别这些瞬时接触。一旦相互作用的成分被共价偶联,可以使用其他步骤(例如细胞裂解,亲和纯化和电泳)来制备分析样品,同时可维持的相互作用复合物。
生物导弹研究(靶向药物)
将能识别肿瘤表面抗原的抗体与药物共价连接,实现靶向治疗,从而减少传统化疗方法对健康细胞的杀伤。
载体蛋白与半抗原的连接
半抗原只有反应原性而没有免疫原性。而将病毒包被蛋白的一段多肽序列(半抗原)可以和载体蛋白连接后制成疫苗,激发免疫反应。另外也可以通过这种方法制备单克隆抗体,并利用此单抗返回找到大分子蛋白上的抗原结合位点。在连接二者的操作中,较低的半抗原–载体蛋白摩尔比会带来更高的抗体亲和力。
此外将半抗原连接在载体蛋白中间的氨基酸上比连接在其末端时产生的的抗体效价更高。
蛋白质或其他分子的固相化
将蛋白质通过共价键结合在磁珠,96孔板,玻璃等等固体基质上,以减少洗脱过程中的损失。
抗体的标记、标记转移
将抗体与酶,荧光基团或者生物素连接用于定量测量或者定位观察。抗体标记与修饰之前,需要用固定化的抗原纯化。为了避免抗体结合抗原的位点被封闭,选择抗体重链上合适位置的的氨基酸就比较重要。标记酶可以连接在抗体铰链区打开形成的二硫键上,或者或者抗体的非特异性片段上。
此外,还可以将抗体酶切,获得抗原结合片段,然后将标记基团与抗原结合片段连接。这种方法的优势是在ELISA反应中减少了Fc片段的干扰,并且也增加了这一复合物的膜通透性,使之更适合标记活体细胞。左图是将标记基团结合在铰链区二硫键打开生成的巯基上。右图是将标记基团直接结合在抗体结合片段上。
交联是指将两个或多个分子通过共价键化学结合的过程。 交联剂包含具有反应活性的末端,可与位于蛋白或其他分子上的特定功能基团,如伯胺和巯基反应。 蛋白和多肽上有多个化学基团可用于交联,因此蛋白和多肽可以作为偶联的靶标,用于使用交联方法的研究中。
交联剂用于确定邻近蛋白间的关系以及配体–受体相互作用。 具有氨基反应活性的同型双功能的交联剂:琥珀酰亚氨酯或亚氨酸酯、以及具有氨基反应活性和光活化叠氮苯化合物的异型双功能交联剂是这些应用中常用的交联剂。
交联剂也常用于修饰核酸、药物和固相载体表面。 用于氨基酸和核酸表面修饰和标记的化学原理是相同的。 该化学领域称为生物偶联,包括交联、固定、表面修饰和生物分子标记。


